درمان بیماری شارکو ماری توث + علل، علائم، انواع و تشخیص
بیماری شارکو ماری توث چیست؟
بیماری شارکو ماری توث یا CMT (Charcot-Marie-Tooth) یکی از شایع ترین اختلالات وراثتی عصبی است که تقریباً از هر 2500 نفر در ایالات متحده یک نفر به آن مبتلا می شوند.
این بیماری به نام سه پزشکی که برای اولین بار در سال 1886 آن را شناسایی کردند – ژان مارتین شارکو و پیر ماری در پاریس، فرانسه، و هوارد هنری توث در کمبریج، انگلستان، نامگذاری شده است.
بیماری شارکو ماری توث که با عنوان نوروپاتی وراثتی حرکتی و حسی (HMSN) یا آتروفی عضلانی پرونئال نیز شناخته می شود، شامل گروهی از اختلالات است که اعصاب محیطی را درگیر می کنند.
اعصاب محیطی خارج از مغز و نخاع قرار دارند و ماهیچه ها و ارگان های حسی در اندام ها را عصب دهی می کنند. به اختلالات آسیب زننده به اعصاب محیطی نوروپاتی محیطی می گویند.
بیماری شارکو ماری توث که با عنوان نوروپاتی وراثتی حرکتی و حسی نیز شناخته می شود، شامل گروهی از اختلالات است که اعصاب محیطی را درگیر می کند، که اگر به موقع درمان نشود ممکن است آسیب های جبران ناپذیری را به دنبال خواهد داشت. برای تشخیص و درمان بیماری شارکو ماری توث می توانید به کلینیک یادمان طب در تهران مراجعه کنید.
علائم شارکو ماری توث
نوروپاتی CMT بر اعصاب حرکتی و حسی تأثیر می گذارد (اعصاب حرکتی باعث انقباض ماهیچه ها شده و فعالیت ارادی عضلات را هنگام صحبت کردن، راه رفتن، تنفس و بلع و … کنترل می کنند).
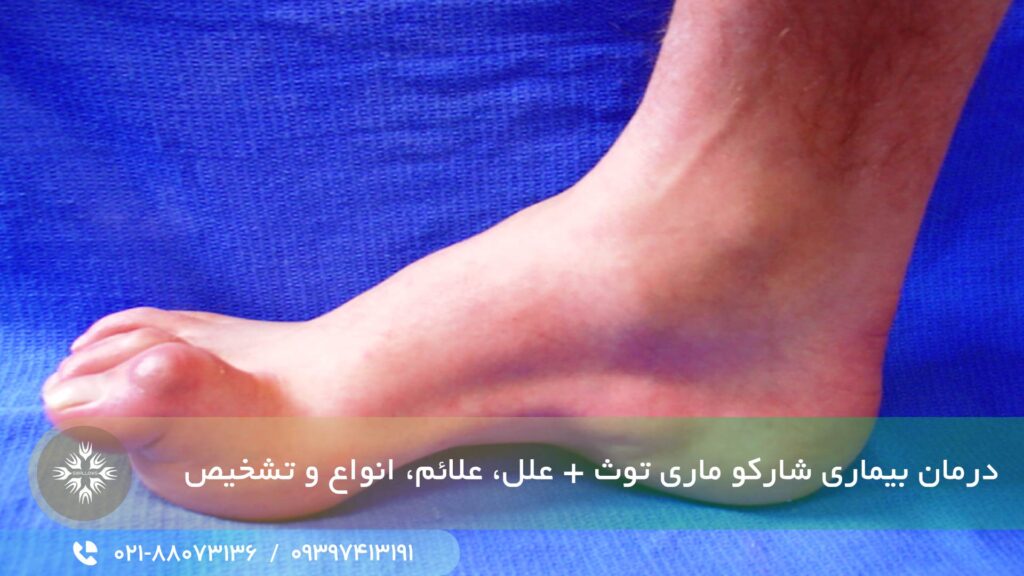
مشخصه های معمول این بیماری شامل ضعف عضلات پا و ساق پا است که می تواند منجر به افتادگی پا و راه رفتن با گام های بلند و سکندری خوردن های مکرر و زمین خوردن شود.
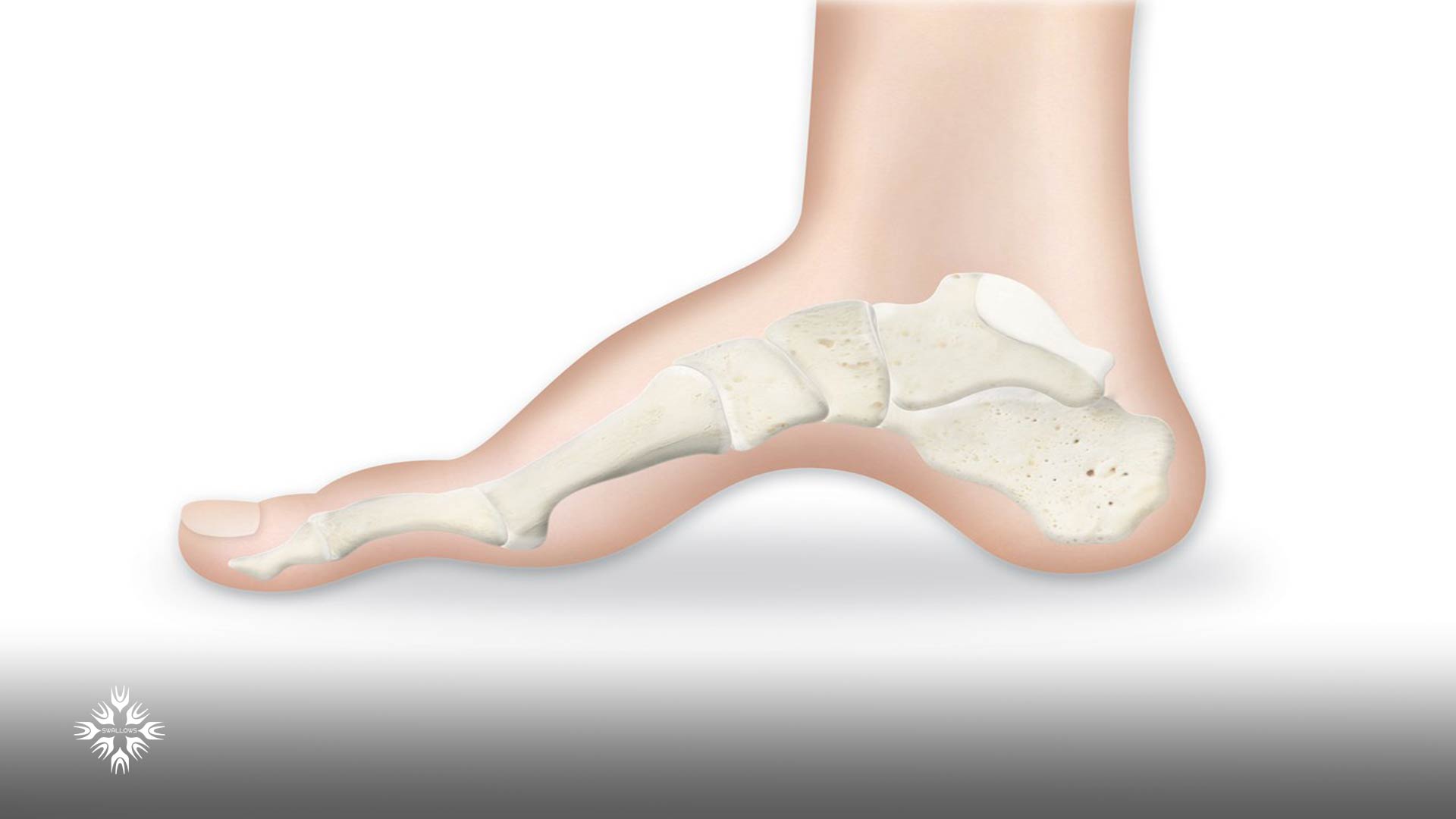
به دلیل ضعف عضلات کوچک پا، بدشکلیهای پا، مانند قوس زیاد و انگشت چکشی (عارضه ای که در آن مفصل میانی انگشت پا به سمت بالا خم میشود) نیز از مشخصه های این بیماری هستند.
علاوه بر این، ساق پاها ممکن است به دلیل از دست دادن حجم عضلانی ظاهری شبیه «بطری شامپاین معکوس» به خود بگیرد.
مدتی پس از شروع بیماری، احتمال بروز ضعف و آتروفی عضلانی در دستها وجود دارد که در نتیجه آن انجام حرکات ظریف (هماهنگی حرکات کوچک معمولاً در انگشتان، دستها، مچها، پاها و زبان) مشکل می شود.
علائم در بیشتر افراد در نوجوانی یا اوایل بزرگسالی و در برخی از افراد در اواسط بزرگسالی شروع می شود. شدت علائم در بین افراد، حتی در بین اعضای یک خانواده، بسیار متفاوت می باشد.
پیشرفت علائم تدریجی است. درد می تواند از خفیف تا شدید متغیر باشد و برخی از افراد ممکن است برای حفظ قدرت تحرک نیاز به استفاده از بریس های پا یا ساق پا یا سایر وسایل ارتوپدی داشته باشند.
اگرچه در موارد نادر، ضعف عضلات تنفسی مشاهده شده است، اما بیماری شارکو ماری توث یک بیماری کشنده در نظر گرفته نمی شود و امید به زندگی برای افراد مبتلا به اکثر اشکال CMT مانند افراد سالم است.
بیشتر بخوانید : آسیب های اعصاب محیطی
علت بیماری شارکو ماری توث
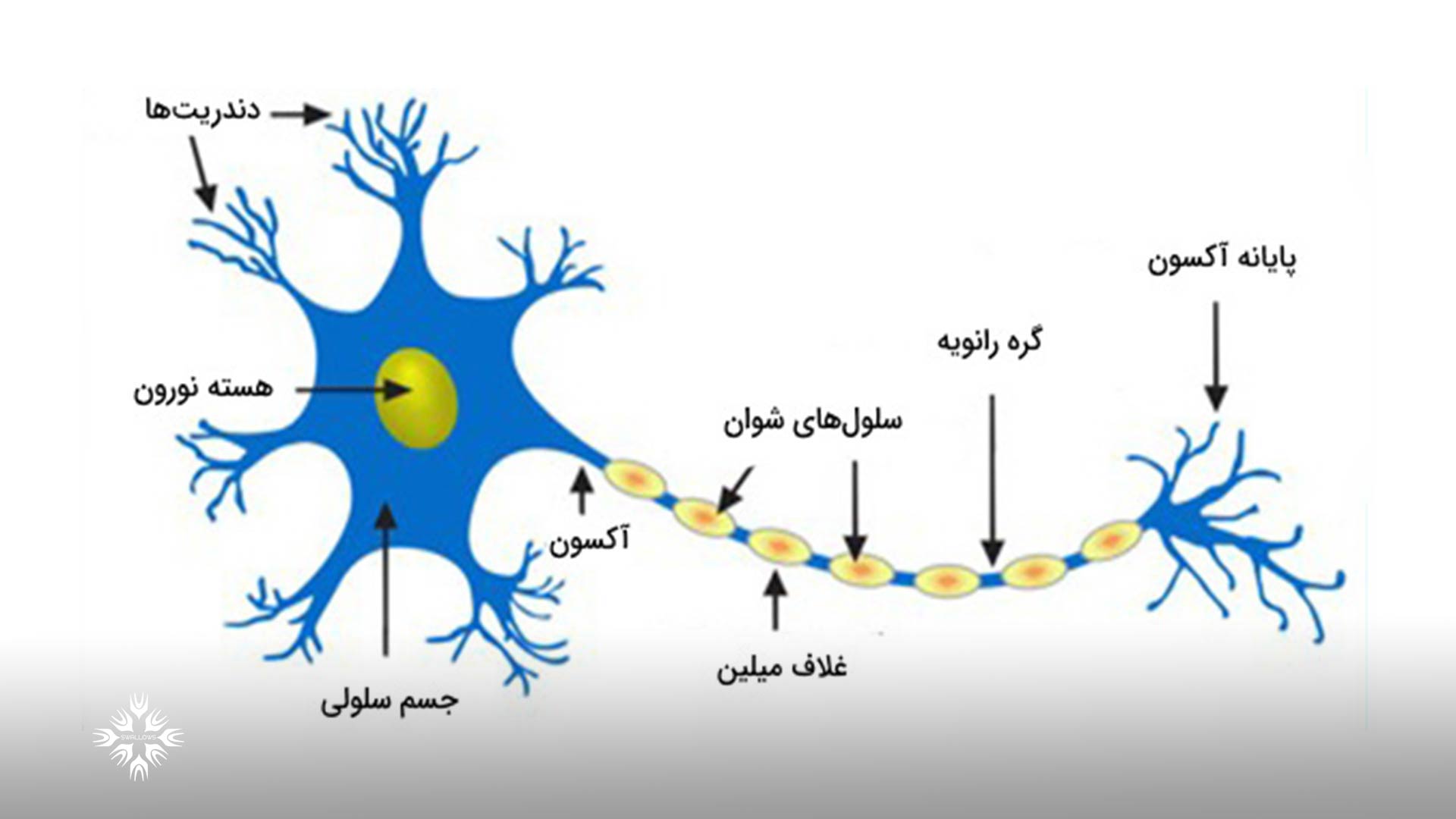
یک سلول عصبی با ارسال سیگنالهای الکتریکی به بخش طولانی و نازک سلول به نام آکسون، اطلاعات را به اهداف دور منتقل میکند.
به منظور افزایش سرعت انتقال این سیگنال های الکتریکی، آکسون با میلین تولیده شده توسط نوع دیگری از سلول به نام سلول شوان عایق بندی می شود.
میلین با پیچیدن به دور آکسون مانند یک کیک ژله ای رول، مانع از دست رفتن سیگنال های الکتریکی می گردد.
بدون آکسون سالم و غلاف میلین، سلولهای عصبی محیطی قادر به فعال کردن عضلات هدف یا انتقال اطلاعات حسی از اندامها به مغز نیستند.
بیماری شارکو ماری توث ناشی از جهش در ژن هایی است که پروتئین های موثر در ساختار و عملکرد آکسون عصب محیطی یا غلاف میلین را تولید می کنند.
اگرچه در اشکال مختلف بیماری CMT، پروتئینهای متفاوتی غیرطبیعی می شوند، اما در همه جهشها عملکرد طبیعی اعصاب محیطی مختل می گردد.
در نتیجه، این اعصاب به آرامی تحلیل رفته و توانایی برقراری ارتباط با اهداف دور خود را از دست میدهند.
تحلیل رفتن اعصاب حرکتی منجر به ضعف و آتروفی عضلات در اندامها (بازوها، پاها، دستها یا پاها) و تحلیل اعصاب حسی منجر به کاهش توانایی احساس گرما، سرما و درد میشود.
جهش های ژنی در بیماری CMT معمولاً ارثی هستند. هر یک از ما به طور معمول دارای دو نسخه از هر ژن هستیم که هر یک از آنها از یک والد به ارث رسیده است.
برخی از اشکال CMT به صورت اتوزومال غالب به ارث می رسند، به این معنی که تنها یک کپی از ژن غیر طبیعی برای ایجاد بیماری کافی است.
سایر اشکال CMT به صورت اتوزومال مغلوب به ارث می رسند، به این معنی که برای ایجاد بیماری باید هر دو نسخه از ژن غیر طبیعی وجود داشته باشد.
اشکال دیگر CMT به صورت وابسته به کروموزوم X به ارث می رسند، به این معنی که ژن غیر طبیعی روی کروموزوم X قرار دارد.
کروموزوم های X و Y جنسیت فرد را تعیین می کنند. افراد دارای دو کروموزوم X مونث و افراد دارای یک کروموزوم X و Y مذکر هستند.
در موارد نادر، جهش ژنی ایجادکننده بیماری CMT، یک جهش جدید است که به طور خود به خودی در ماده ژنتیکی فرد ایجاد شده و از طریق خانواده منتقل نشده است.
انواع بیماری شارکو ماری توث چیست؟
انواع مختلفی از بیماری شارکو ماری توث وجود دارد، از جمله CMT1، CMT2، CMT3، CMT4 و CMTX .
CMT1 که در اثر ناهنجاری در غلاف میلین ایجاد می شود، دارای سه نوع اصلی است.
CMT1A یک بیماری اتوزومال غالب است که از تکرار ژن روی کروموزوم 17 ناشی می شود. این ژن حاوی دستورالعمل های تولید پروتئین میلین محیطی 22 (PMP-22) است.
پروتئین PMP-22 جزء حیاتی غلاف میلین است. بیان بیش از حد این ژن باعث غیر طبیعی شدن ساختار و عملکرد غلاف میلین می شود.
بیماران در سنین نوجوانی ضعف و آتروفی عضلات ساق پا را تجربه می کنند و بعد از مدتی دچار ضعف دست و از دست رفتن حس می شوند.
جالب توجه است که یک نوروپاتی محیطی مجزای دیگر به نام نوروپاتی ارثی همراه با استعداد فلج فشاری (HNPP) که متفاوت از CMT1A است به دلیل حذف یکی از ژن های PMP-22 ایجاد می شود.
در این مورد، سطح غیر طبیعی پایین PMP-22، منجر به نوروپاتی دمیلینه کننده اپیزودیک وعود کننده می شود.
CMT1B یک بیماری اتوزومال غالب ناشی از جهش در ژنی است که حاوی دستورالعملهای تولید پروتئین میلین صفر (P0) است که یکی دیگر از اجزای حیاتی غلاف میلین می باشد.
بیشتر این جهشها جهشهای نقطهای هستند، به این معنی که اشتباه فقط در یک حرف از کد ژنتیکی DNA رخ میدهد. تا به امروز، دانشمندان بیش از 120 جهش نقطه ای مختلف را در ژن P0 شناسایی کرده اند.
به دلیل وجود ناهنجاری در P0، CMT1B علائمی مشابه CMT1A ایجاد می کند.
CMT1C، CMT1D و CMT1E که شیوع کمتر و باز هم علائمی مشابه CMT1A دارند، به ترتیب در اثر جهش در ژن های LITAF، EGR2 و NEFL ایجاد می شوند.
در CMT2 ناهنجاری به جای غلاف میلین در آکسون سلول عصبی محیطی است. این نوع کمتر از CMT1 شیوع دارد. CMT2A، رایج ترین فرم آکسونال شارکو ماری توث است که به دلیل جهش در میتوفوزین 2 ایجاد می شود؛ پروتئینی که در همجوشی میتوکندری نقش دارد.
CMT2A همچنین با جهش در ژن کد کننده پروتئین 1B-beta_ عضوی از خانواده کینزین_ ارتباط دارد، اما این مورد در انواع دیگر تکرار نشده است.
کینزین ها پروتئین هایی هستند که به عنوان موتورهایی برای کمک به انتقال مواد در سلول عمل می کنند.
سایر اشکال کمتر شایع CMT2 که اخیراً شناسایی شده اند و با ژن های مختلف مرتبط هستند، عبارتند از: CMT2B (مرتبط با RAB7)، CMT2D (GARS)،CMT2E (NEFL)، CMT2H (HSP27) و CMT2l (HSP22).
CMT3 یا بیماری دژرین-سوتاس (Dejerine-Sottas) یک نوروپاتی دمیلینه کننده شدید است که از دوران نوزادی شروع می شود.
این نوزادان آتروفی شدید عضلانی، ضعف و مشکلات حسی دارند. این اختلال نادر می تواند ناشی از یک جهش نقطه ای خاص در ژن P0 یا یک جهش نقطه ای در ژن PMP-22 باشد.
CMT4 شامل چندین زیرگروه مختلف از انواع نوروپاتی های حسی -حرکتی دمیلینه کننده اتوزومال مغلوب است. هر زیرگروه از انواع نوروپاتی در اثر یک جهش ژنتیکی متفاوت ایجاد می شود و در نتیجه ویژگی های فیزیولوژیکی یا بالینی متمایزی ایجاد کرده و نژاد خاصی را تحت تاثیر قرار می دهد.
افراد مبتلا به CMT4 معمولاً از دوران کودکی علائم ضعف پا را دارند و در نوجوانی شاید حتی قادر به راه رفتن نباشند.
چندین ژن به عنوان عامل ابتلا به CMT4 شناسایی شده اند، از جمله GDAP1 (CMT4A)، MTMR13 (CMT4B1)، MTMR2 (CMT4B2)، SH3TC2 (CMT4C)، NDG1 (CMT4D)، EGR2 (CMT4E)، PRX (CMT4F)، FDHMTG4 (CMT4F)، و FIG4 (CMT4J).
CMTX توسط یک جهش نقطه ای در ژن کانکسین-32 در کروموزوم X ایجاد می شود. پروتئین کانکسین-32 در سلولهای شوان بیان میشود، سلول هایی که با پیچیده شدن در اطراف آکسونهای عصبی، یک بخش واحد از غلاف میلین را تشکیل میدهند.
احتمال نقش داشتن این پروتئین در ارتباط برقرار کردن سلول شوان با آکسون وجود دارد.
مردانی که یک ژن جهش یافته را از مادر خود به ارث می برند، علائم متوسط تا شدید بیماری را در اواخر دوران کودکی یا نوجوانی تجربه می کنند (کروموزوم Y که مردان از پدران خود به ارث می برند، ژن کانکسین-32 را ندارد).
زنانی که یک ژن جهش یافته را از یکی از والدین و یک ژن طبیعی را از والد دیگر به ارث می برند، ممکن است علائم خفیفی را در نوجوانی یا بعد از آن تجربه کنند یا اصلاً علائم بیماری را نداشته باشند.
بیماری شارکو ماری توث چگونه تشخیص داده می شود؟
تشخیص بیماری شارکو ماری توث یا CMT با بررسی سابقه پزشکی، سابقه خانوادگی و معاینه عصبی شروع می شود. از افراد در مورد ماهیت و طول مدت علائم آنها و مبتلا بودن یا نبودن سایر اعضای خانواده به این بیماری سؤال می شود.
در طول معاینه عصبی، پزشک به دنبال نشانه هایی مبنی بر ضعف عضلانی در بازوها، پاها، دستها و پاها، کاهش حجم عضلانی، کاهش رفلکسهای تاندون و از دست دادن حس میگردد.
پزشکان پاها را نیز برای یافتن نشانه هایی از ناهنجاریهای پا مانند قوسهای زیاد، انگشتان چکشی، انحراف مچ پا یا صافی کف پا معاینه می کنند.
در صورت ابتلا به این عارضه احتمال وجود سایر مشکلات ارتوپدی مانند اسکولیوز خفیف یا دیسپلازی مفصل ران نیز وجود دارد.
نشانه خاصی که ممکن است در افراد مبتلا به CMT1 یافت شود، بزرگ شدن عصب است، تا حدی که امکان دارد از روی پوست احساس یا حتی دیده شود.
این اعصاب بزرگ شده که به آنها اعصاب هیپرتروفیک می گویند به علت ضخامت غیر طبیعی غلاف های میلین به وجود می آیند.
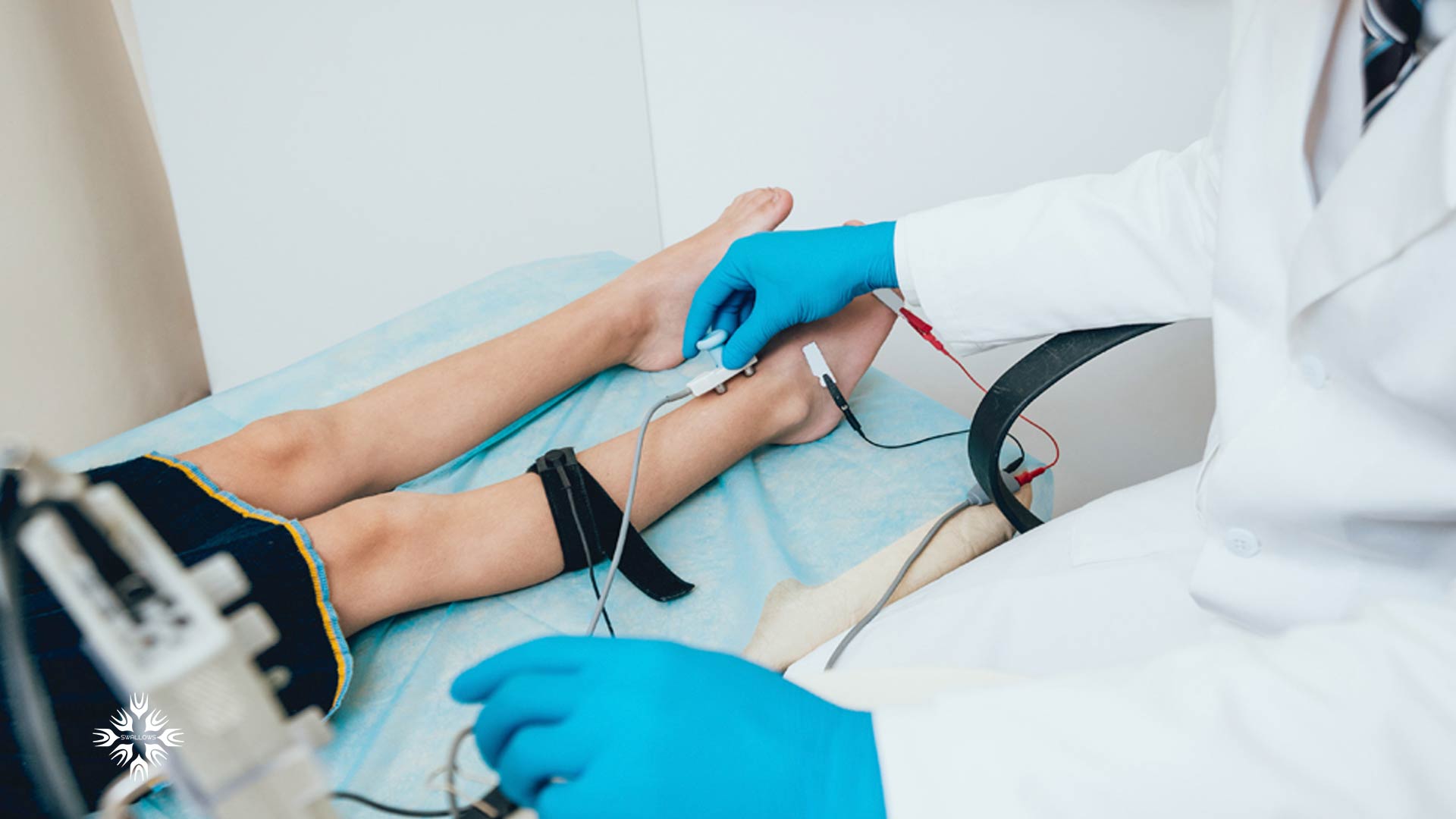
پزشک در صورت مشکوک بودن به CMT، ممکن است آزمایشات الکترودیاگنوستیک را تجویز کند. این آزمایش از دو بخش تشکیل شده است: مطالعات هدایت عصبی و الکترومیوگرافی (EMG).
در طول مطالعات هدایت عصبی، الکترودها روی پوست و بالای یک عصب حرکتی یا حسی محیطی قرار می گیرند. این الکترودها یک شوک الکتریکی کوچک ایجاد می کنند که شاید کمی ناراحت کننده باشد.
این تکانه الکتریکی اعصاب حسی و حرکتی را تحریک کرده و اطلاعات قابل سنجشی را ارائه می دهد که پزشک می تواند از آن برای تشخیص استفاده کند.
درEMG یک الکترود سوزنی برای اندازهگیری فعالیت بیوالکتریکی عضلات از طریق پوست وارد عضله می شود.
ناهنجاری های خاص مشاهده شده در فعالیت عضلات نشان دهنده دژنراسیون آکسون است. تست نوار عصب و عضله ممکن است برای توصیف بیشتر توزیع و شدت درگیری عصب محیطی مفید باشد.
آزمایش ژنتیک برای برخی از انواع شارکو ماری توث در دسترس است و نتایج معمولاً برای تأیید تشخیص کافی است. علاوه بر این، برای کمک به افراد در درک وضعیت خود و برنامه ریزی برای آینده می توان مشاوره ژنتیک انجام داد.
اگر نتیجه تمام آزمایشهای ژنتیکی یا تست دوباره موارد غیرقطعی منفی شود، متخصص مغز و اعصاب ممکن است برای تأیید تشخیص، بیوپسی عصب را انجام دهد.
بیوپسی عصب شامل برداشتن یک قطعه کوچک از عصب محیطی از طریق یک برش در پوست است. این کار اغلب با برداشتن بخشی از عصب که از ساق پا می گذرد انجام می شود. سپس عصب را زیر میکروسکوپ بررسی می کنند.
افراد مبتلا به CMT1 معمولاً علائم میلیناسیون غیر طبیعی را دارند. به طور خاص، تشکیل چیزی شبیه ” گیاه پیازی ” نشان دهنده احاطه شدن آکسون ها توسط لایه هایی از سلول های شوان دمیلینه کننده و رمیلینه کننده مجدد است.
افراد مبتلا به CMT1 معمولاً علائم دژنراسیون آکسون را دارند. اخیراً از بیوپسی پوست برای مطالعه رشتههای عصبی بدون میلین و میلین دار به روش کم تهاجمی استفاده شده است، اما استفاده بالینی از آنها در مورد CMT هنوز صورت نگرفته است.
درمان بیماری شارکو ماری توث
هیچ درمانی برای بیماری شارکو ماری توث وجود ندارد، اما فیزیوتراپی، کاردرمانی، بریس ها و سایر وسایل ارتوپدی و حتی جراحی ارتوپدی می تواند به افراد برای کنار آمدن با علائم ناتوان کننده بیماری کمک کند.
علاوه بر این، برای افرادی که درد شدید دارند، می توان داروهای مسکن تجویز کرد.
فیزیوتراپی و کاردرمانی که درمان ارجح برای بیماری شارکو ماری توث محسوب می شوند، شامل تمرینات قدرتی عضلانی، کشش عضلات و رباطها، تمرین استقامتی و ورزش هوازی متوسط است.
اکثر درمانگران یک برنامه درمانی تخصصی را توصیه می کنند که با تایید پزشک بیمار و متناسب با توانایی ها و نیازهای فردی او طراحی شده است.
درمانگران همچنین پیشنهاد می کنند که زودتر یک برنامه درمانی را شروع کنید. با تقویت عضلات می توان آتروفی عضلانی را به تاخیر انداخت یا کاهش داد، بنابراین انجام تمرین قدرتی قبل از تخریب عصب و پیشرفت ضعف ماهیچه ها تا نقطه ناتوانی، بیشترین تاثیر را خواهد داشت.
با کشش می توان از ناهنجاری های مفصلی که در نتیجه کشش نامتناسب عضلانی روی استخوان ها ایجاد می شود، جلوگیری کرد یا آنها را کاهش داد.
ورزش های مفید در ایجاد یا افزایش استقامت، به جلوگیری از خستگی ناشی از انجام فعالیت های روزمره که نیاز به قدرت و تحرک دارند کمک می کنند.
فعالیت هوازی متوسط برای حفظ آمادگی قلبی عروقی و سلامت کلی مفید هستند.
اکثر درمانگران به جای فعالیت هایی مانند پیاده روی یا آهسته دویدن که ممکن است بر عضلات و مفاصل شکننده فشار وارد کنند، ورزش های کم برخورد یا بدون برخورد مانند دوچرخه سواری یا شنا را توصیه می کنند.
بسیاری از افراد مبتلا به بیماری شارکو ماری توث برای حفظ تحرک روزانه و جلوگیری از آسیب به مچ بند و سایر وسایل ارتوپدی نیاز دارند.
مچ بند با ایجاد حمایت و ثبات در حین فعالیت هایی مانند راه رفتن یا بالا رفتن از پله ها از پیچ خوردگی مچ پا جلوگیری می کند.
با پوشیدن کفش ها یا چکمه های بلند نیز می توان از مچ پاهای ضعیف محافظت کرد. آتل شست می تواند به کاهش ضعف دست و از دست دادن مهارت های حرکتی ظریف کمک کند.
قبل از شروع ناتوانی باید از وسایل کمکی استفاده کرد زیرا استفاده از این وسایل مانع از کشیدگی عضلات و ضعیف شدن آنها می شود.
برخی از افراد مبتلا به CMT برای ترمیم ناهنجاری های پا و مفصل، تصمیم به جراحی ارتوپدی می گیرند.
بیشتر بخوانید : تمرینات نوروپاتی محیطی
چه تحقیقاتی در این باره در حال انجام است؟
NINDS از تحقیقات در مورد CMT و سایر نوروپاتی های محیطی که هدف شان یادگیری نحوه درمان، پیشگیری و حتی درمان بهتر این اختلالات است، پشتیبانی می کند.
تحقیقات در حال انجام شامل تلاشهایی برای شناسایی بیشتر ژنها و پروتئینهای جهشیافته مسئول انواع مختلف بیماری، کشف مکانیسمهای انحطاط عصبی و آتروفی عضلانی با امید به توسعه مداخلاتی برای متوقف کردن یا کند کردن این فرآیندهای ناتوانکننده و تلاشها برای یافتن درمان هایی برای معکوس کردن روند دژنراسیون عصبی و آتروفی عضلانی است.
یکی از زمینه های امیدوارکننده، تحقیقات در مورد آزمایش های ژن درمانی است. تحقیقات با کشت های سلولی و مدل های حیوانی نشان داده است که می توان ژن ها را به سلول ها و ماهیچه های شوان رساند.
یکی دیگر از حوزههای تحقیقاتی استفاده از عوامل تغذیهای یا فاکتورهای رشد عصبی، مانند هورمون آندروژن، برای جلوگیری از انحطاط عصبی است.
در مورد تاثیر ویتامین C در CMT1A مطالعه شده است و نتایج یک کارآزمایی چند مرکزی به زودی ارائه می شود. در حال حاضر مطالعاتی بر روی کورکومین، یکی از موارد تشکیل دهنده کاری، به عنوان یک استراتژی درمانی در مدل حیوانی CMT1B در حال انجام است.
برای دریافت مشاوره و یا نوبت حضوری با شماره تلفن های : ۰۲۱۸۸۰۷۳۱۳۶ و یا از طریق تماس تلفنی و یا واتساپ با شماره ۰۹۳۳۷۸۳۶۸۲۰ در تماس باشید.
سایر شماره تماس های کلینیک ۰۲۱۸۸۵۷۱۵۲۳ و ۰۲۱۸۸۵۹۱۳۵۸
آدرس ما را در صفحه تماس با ما مشاهده کنید.